
विषय
- दिशाओं
- वैलेंस लेयर में इलेक्ट्रॉनों की संख्या
- लुईस की संरचना
- प्रत्येक परमाणु का औपचारिक प्रभार
- चेतावनी
- आपको क्या चाहिए
किसी अणु के औपचारिक आवेश जैसे CoCl2 (फोसजीन गैस) का निर्धारण करते समय, प्रत्येक अणु के वैलेय परत में इलेक्ट्रॉनों की संख्या और अणु की लुईस संरचना को जानना आवश्यक है।
दिशाओं

-
वैलेंस लेयर में इलेक्ट्रॉनों की संख्या निर्धारित करने के लिए तत्वों की आवर्त सारणी में प्रत्येक परमाणु की तलाश करें।
-
याद रखें कि दो इलेक्ट्रॉन पहले उप-स्तरीय एस में हैं, दो दूसरे उप-स्तरीय एस में हैं, पहले उप-स्तरीय पी में छह इलेक्ट्रॉन, और इसी तरह। स्मरण करें: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6)।
-
लोड मारा। यदि अणु एक आयन है, तो अंतिम चार्ज तक पहुंचने के लिए कुल से एक या एक से अधिक इलेक्ट्रॉनों को जोड़ना या घटाना।
-
CoCl2 (फॉस्जीन गैस) के लिए: C = 4; ओ = 6; Cl = 7. अणु आयनीकृत नहीं होता है और एक तटस्थ चार्ज होता है। इसलिए, घाटी परत में इलेक्ट्रॉनों की कुल संख्या 4 + 6 + (7x2) = 24 है।
वैलेंस लेयर में इलेक्ट्रॉनों की संख्या
-
CoCl2 (फोसजीन गैस) की लुईस संरचना आरेख देखें। लुईस संरचना अणु के लिए सबसे स्थिर और संभावित संरचना का प्रतिनिधित्व करती है। परमाणुओं को युग्मित वैलेंस इलेक्ट्रॉनों के साथ खींचा जाता है; ऑक्टेट नियम को संतुष्ट करने के लिए मुक्त इलेक्ट्रॉनों के बीच बांड का गठन किया जाता है।
-
प्रत्येक परमाणु और उसके वैलेंस इलेक्ट्रॉनों को ड्रा करें और फिर आवश्यकतानुसार बॉन्ड बनाएं।
इलेक्ट्रॉन लुईस संरचना पर खींचे गए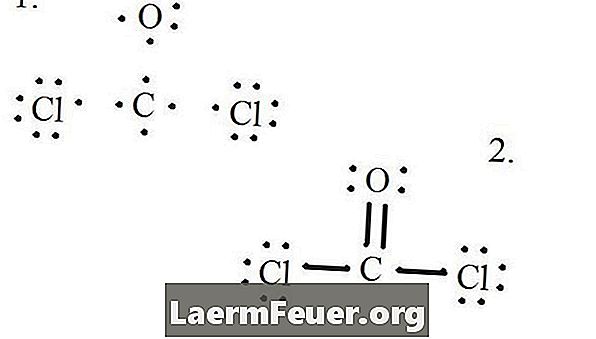
-
क्लोराइड परमाणु कार्बन अणु के साथ एकल बांड साझा करते हैं, जबकि ऑक्सीजन परमाणु कार्बन के साथ दोहरा बंधन बनाते हैं। अंतिम संरचना में प्रत्येक परमाणु ऑक्टेट नियम को संतुष्ट करता है और इसमें आठ इलेक्ट्रॉन होते हैं, जो आणविक स्थिरता की अनुमति देते हैं।
लुईस की संरचना
-
लुईस संरचना में प्रत्येक परमाणु के मुक्त इलेक्ट्रॉन जोड़े की गणना करें। प्रत्येक परमाणु प्रत्येक बंध का एक इलेक्ट्रॉन नामित करता है जिसमें से वह भाग लेता है। इन नंबरों को जोड़ें। CoCl2 में: C = 0 मुक्त जोड़े और 4 बंध इलेक्ट्रॉन = 4 इलेक्ट्रॉन। नि: शुल्क जोड़े के ओ = 4 इलेक्ट्रॉनों और बांडों के 2 इलेक्ट्रॉनों = 6 इलेक्ट्रॉनों। सी = 7 इलेक्ट्रॉनों के साथ एक जोड़े के एक जोड़े के साथ मुक्त जोड़े के क्ल = 6 इलेक्ट्रॉनों।
-
अनबाउंड परमाणु पर वैलेंस परत में इलेक्ट्रॉनों की संख्या की मात्रा को घटाएं। परिणाम प्रत्येक परमाणु के लिए औपचारिक प्रभार है। CoCl2 में: C = 4 वेलेंस इलेक्ट्रॉनों (ev) में अनबाउंड एटम माइनस 4 इलेक्ट्रॉनों को लुईस संरचना (LS) = 0 औपचारिक चार्ज O = 6 ev - 6 LS = 0 औपचारिक चार्ज Cl = 7 और 7 - LS = में निर्दिष्ट किया गया है। 0 औपचारिक प्रभार
परमाणुओं का औपचारिक प्रभार
-
लिखते समय, इन आरोपों को लुईस संरचना में परमाणुओं के पास रखें। यदि कुल में अणु में चार्ज है, तो ऊपरी दाएं कोने में बाहर की ओर लिखे गए चार्ज के साथ कोष्ठक में लेविस संरचना रखें।
प्रत्येक परमाणु का औपचारिक प्रभार
चेतावनी
- संक्रमण धातुओं वाले अणुओं के लिए औपचारिक प्रभार की गणना विश्वासघाती हो सकती है। संक्रमण धातुओं के लिए घाटी परत में इलेक्ट्रॉनों की संख्या कुलीन गैस पैटर्न से बाहर होगी।
आपको क्या चाहिए
- तत्वों की आवर्त सारणी